란 기계ㆍ설비가 설계한 대로 제작, 설치되고 목적한 대로 작동하여 원하는 결과가 얻어진다는 것을 증명하고 이를 문서화하는 것을 말한다.
이란 특정한 공정, 방법, 기계설비 또는 시스템이 미리 설정되어 있는 판정기준에 맞는 결과를 일관되게 도출한다는 것을 검증하고 이를 문서화하는 것을 말한다.
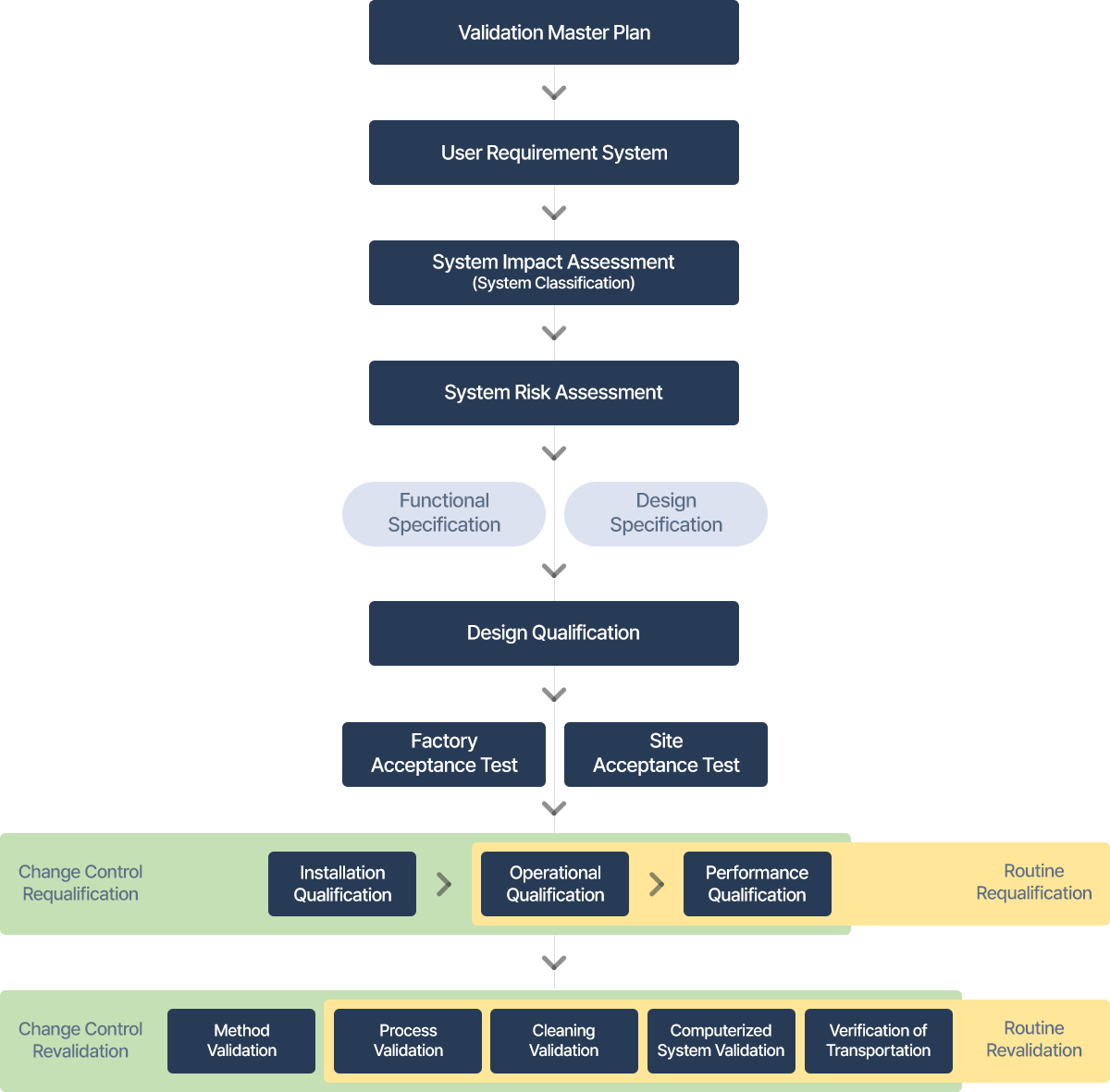
란 시설, 시스템 및 설비의 예정된 설계가 사용목적에 적합하다는 문서화된 입증을 말한다.
란 설치 또는 변경된 시설, 시스템 및 설비가 승인된 설계 및 공급업체의 권고사항에 부합한다는 문서화된 입증을 말한다.
란 설치 또는 변경된 시설, 시스템 및 설비가 예상 운전 범위 내에서 의도된 대로 작동된다는 문서화된 입증을 말한다.
란 시스템, 설비가 승인된 공정 방법 및 제품 규격에 근거하여 효과적이고 재현성 있게 작동할 수 있다는 문서화된 검증을 말한다.
란 설비, 시설, 지원설비 및 시스템이 관리 상태로 유지되고 있음을 확인하여 적절한 주기로 평가하는 것을 말한다.
·CQA(Critical Quality Attribute) 및 CPP (Critical Process
Parameter)를 도출하여 장비에 대한 잠재적 위험 및 영향을 평가
·RQ 진행 시 위험분석을 통해 Execution 항목과 범위 선정
·위험분석을 통해 선정된 수행 범위 및 단계에 따라 Execution 항목을
선정하여 계획서를 작성
·위험분석에 따라 작성/검토/승인된 계획서에 준하여 수행
·Execution을 통해 도출된 데이터는 적격성평가된
실시자가 보고서에 기록
·기록된 데이터와 사전에 설정된 허용기준 간 비교 후 적합판정
이란 의약품(의료기기) 제조공정이 미리 설정된 기준 및 품질 특성에 맞는 제품을 일관되게 제조한다는 것을 검증하고 문서화하는 것을 말한다.
이란 기계 · 설비 등의 잔류물(전 작업 의약품, 세척제 등)이 적절하게 세척되었는지를 검증하고 문서화하는 것을 말한다.
이란 의약품등의 품질관리를 위한 시험방법의 타당성을 미리 검증하고 문서화하는 것을 말한다.
이란 컴퓨터시스템의 자료를 정확하게 분석·관리·기록하고 미리 정해진 기준에 맞게 자료를 처리한다는 것을 고도의 보증수준으로 검증하고 문서화하는 것을 말한다.
이란 의약품등이 품목허가(신고)사항, 승인된 표시재료, 제품표준서에서 규정한 조건 또는 제조업자가 타당성을 입증한 조건에 따라 운송됨을 검증하고 문서화하는 것을 말한다.
·ICH Q9(품질위험관리) 가이드라인에 따른 공정 위험분석 수행
·위험분석 결과를 반영하여 밸리데이션 계획서 작성
(공정, 세척, 시험 및 분석, 컴퓨터화 시스템, 운송)
·고객사에서 제조, 세척, 측정 및 분석을 수행
·일탈 발생 시 관련 지원 업무 수행
·실시 결과를 바탕으로 보고서 작성