는 제품의 품질 기준을 수립하고 이를 유지할 수 있도록 절차 및 관련 기록들을 문서화하고 규정화하여 모두가 이를 따를 수 있도록 하는 개념을 말합니다.
문서 제·개정을 통한 QMS 구축 컨설팅 프로그램으로, 문서시스템에 대하여 RA(Risk Assessment)를 통한 DI(Data Integrity) 실태진단을 진행,
그 결과를 바탕으로 기준서 및 절차서의 제·개정안을 작성합니다.

문서시스템 현황 파악
고객사가 구축하고자 하는 시스템의 요구사항 파악
관련 규정 파악
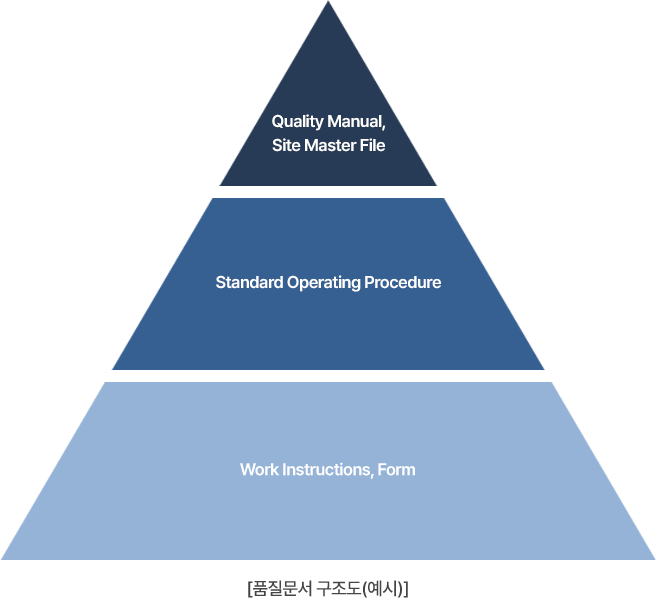
파악한 요구사항 및 규정을 바탕으로 문서의 구조도와 목록(Document Tree),
제·개정 목록을 확립
RA(Risk Assessment) 및 DI(Data Integrity)를 반영한 문서 작성
최종적으로 고객사의 승인을 받은 SOP에 대하여 운영할 수 있도록 전달 교육 수행
sureAssist는 새롭게 도입되는 GMP & GxP 규정에 대하여 발빠르게 분석하고 고객사가 이에 대해 대비할 수 있도록 지원합니다.

EU GMP Annex 1 및 무균의약품 제조(별표1) - Gap분석 및 반영
CCS(Contamination Control Strategy) - 가이드라인을 반영한 CCS를 개발하여 문서화 및 모니터링 시스템 구축
DI(Data Integrity) Gap Analysis - 고객사에서 현재 사용하고 있는 기록문서, 장비 시스템의 데이터 관리 현황을 파악 - 식약처, PIC/S 및 국외에서 발행한 의약품 제조업체 DI (Data Integrity) 평가 지침의 평가항목에 근거하여 현재 운영중인 시스템 평가 - ALCOA+ 원칙에 따라 문서 시스템 및 장비 운영 시스템 검토